大肠杆菌感受态细胞的制备实验
发布时间:2024-07-24 浏览次数:1088
01
简介
在大肠杆菌感受态细胞的制备实验中,通过特殊方法(如电击法或CaCl2法)处理细胞,使得细胞膜的通透性暂时性地发生改变,从而形成能够允许外源DNA分子进入的细胞,这些被称为感受态细胞(Component cells)。
大肠杆菌蛋白表达系统被广泛应用,是经济实惠的蛋白表达系统之一。该系统具有清晰的遗传背景、快速的细胞增殖、高表达量、良好的稳定性以及强大的抗污染能力等特点,因此适用于多种蛋白的表达。
02
实验原理
在大肠杆菌感受态细胞的制备实验中,外源DNA的重组质粒在体外组装完成后,需要引入宿主细胞中。这个过程发生在细胞进行大规模复制和繁殖时,才能获得纯净的重组质粒DNA,这个过程称为转化。通过一些特殊的方法,如使用CaCl2、RuCl等化学试剂处理,可以改变受体细胞的细胞膜通透性,使其能够容纳外源DNA的载体分子。
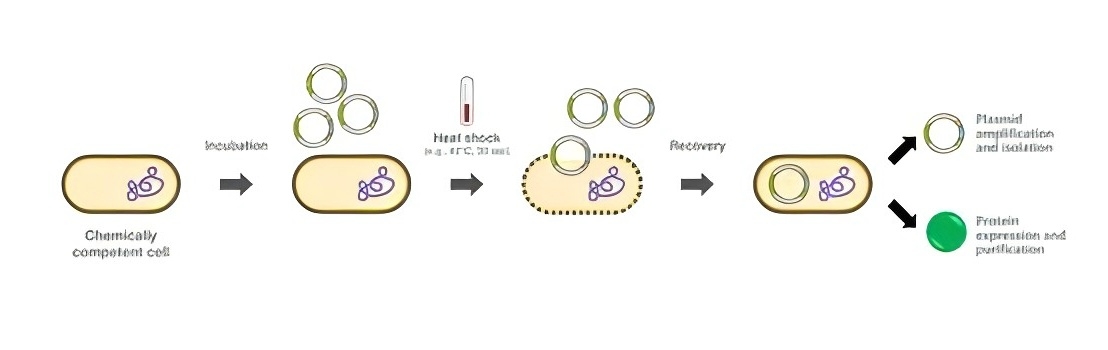
CaCl2法制备感受态细胞(图源网络)
03
实验准备
1.实验材料、试剂
E. coli DH5α菌株、LB固体培养基、LB液体培养基、CaCl2、硫酸镁、SOB、TFB。
2.仪器耗材
培养皿、恒温摇床、聚丙烯管、电热恒温培养箱、台式高速离心机、无菌工作台、烧瓶、恒温水浴锅、低温冰箱、制冰机、分光光度计、微量移液枪、锥形瓶、试管。
04
实验步骤
1.从经过37℃培养16-20小时的培养平板中挑选一个单独的菌落(直径为2-3毫米),并将其转移到一个含有100毫升LB或SOB培养基的1升烧瓶中。在37℃下强烈振荡培养3小时。根据一般经验,1个OD600(光学密度为600纳米)约相当于含有大肠杆菌DH5α 10^9个/mL。
2.将细菌转移到一个经过消毒、只使用一次的、事先用冰冷却的50毫升聚丙烯管中。将培养物置于冰上静置10分钟,使其冷却至0℃。
3.在4℃条件下,使用Sorvall GS3特制离心头(或类似的离心头),以每分钟4,100转的速度离心10分钟,以回收细胞。
4.倒出培养液,将管倒置1分钟以使最后的痕量培养液流尽。
5.每50毫升的起始培养液使用30毫升预冷的0.1 mol/L CaCl2-MgCl2 溶液(80 mmol/L MgCl2,20 mmol/L CaCl2)重新悬浮每份细胞沉淀。
6.于4℃用Sorvall GS3转头(或与之相当的转头)以4100 r/min离心10 min,以回收细胞。
7.倒出培养液,将管倒置1分钟以使最后的痕量培养液流尽。
8.每50 ml初始培养物用2 ml用冰预冷的0.1 mol/L CaCl2(或TFB)重悬每份细胞沉淀。
9.此时,可以用新鲜制备的感受态细胞直接做转化实验,也可以将细胞冻存于-70℃。
05
感受态细胞制备及转化中的影响因素
1. 细胞的生长状态和密度
从-70℃或-20℃甘油保存的菌种中直接转接用于制备感受态细胞的菌液。细胞生长密度以每毫升培养液中的细胞数在5×107个左右为佳。对于TG1菌株,当OD600为0.5时,细胞密度在5×107个/ml左右。受体细胞一般应是限制-修饰系统缺陷的突变株,不含限制性内切酶和甲基化酶的突变株。制备出的感受态细胞暂时不用时,可加入占总体积10%-15%的无菌甘油或-70℃保存。
2. 质粒DNA的质量和浓度
用于转化的质粒DNA应为超螺旋态的,转化率与外源DNA的浓度在一定范围内成正比。加入的外源DNA量过多或体积过大会使转化率下降。DNA溶液的体积不应超过感受态细胞体积的5%。质粒分子量过大的转化效率低,大于30kb的重组质粒难以进行转化。重组DNA分子的构型与转化效率密切相关,环状重组质粒的转化率较线性重组质粒高10~100倍。
3. 试剂的质量
所用的CaCl2等试剂应是最高纯度的,并用最纯净的水配制,最好分装保存于4℃。
4. 防止杂菌和杂DNA的污染
操作过程应在无菌条件下进行,使用新的离心管、移液枪头,并经高压灭菌处理。所有试剂都要灭菌,并注意防止被其他试剂、DNA酶或杂DNA所污染,否则会影响转化效率或杂DNA的转入。
5. 操作需在冰上进行,不能离开冰浴,否则细胞转化率将会降低。
06
注意事项
1. 为确保高效转化,细胞活力应保持在每毫升10^8个细胞以下,对于大多数散大肠杆菌而言,相应的光学密度(OD值)约为0.4左右。为避免细菌培养物的生长密度过高,建议每15-20分钟测定一次OD600值以进行监测。通过记录监测时间和OD值,可制作一个图表来预测培养物达到OD600值0.4所需的时间。当OD600值达到0.35时,即可收获细菌培养物。
2. 不同生长阶段的菌株间,OD值与每毫升中活细胞数量存在显著变化。为了标准化,需测量特定大肠杆菌菌株在其生长周期中不同时间点的OD600值,并将每个稀释度的培养物均匀涂布在不含抗生素的LB琼脂板上,以计算每个时期的活细胞数量,以确保分光光度计的读数标准化。
3. 大多数大肠杆菌(除了MC106)在转化中使用TFB替代CaCl2可以获得相同或更好的结果。根据1979年Dagert和Ehrlieh的实验,细胞在4℃条件下可在CaCl2溶液中保存24-48小时。在最初12-24小时的储存过程中,转化率增加了4-6倍,然后逐渐降低至初始水平。
4. 选择新鲜平板的单克隆以确保克隆的新鲜程度,即刚涂布生长过夜的平板。
5. 菌体的OD600值对转化效率有影响,JM109或BL21的OD值为0.35,DH5α为0.4,应尽量避免过高的OD值,不得超过0.6。
6. 在低温处理后,应在冰上保存12-24小时后分装,并冷冻保存于-80℃。
7. 所有用品(如离心管、药瓶等)应使用新的,若使用旧的,则必须确保其干净,并准备好CaCl2溶液。
来源:环凯转载于“ 誉嘉医学”公众号,原作者~未知,内容版权归原作者所有;
说明:文章、视频、图片等所有内容,仅用于学习交流,若有侵权内容及其他涉法内容,请及时联系删除或修改,特此声明!





