胎牛血清(FBS)解冻和使用注意事项
发布时间:2025-08-04 浏览次数:102
胎牛血清(Fetal Bovine Serum, FBS)是真核细胞体外培养的关键成分,为细胞提供必需的营养和生长因子。
为了确保FBS发挥最佳效果,维持细胞良好状态,掌握正确的使用和保存方法至关重要。以下分享一些实用的操作小tips,帮助小伙伴们养细胞更顺利。
1、胎牛血清初次开封如何解冻?
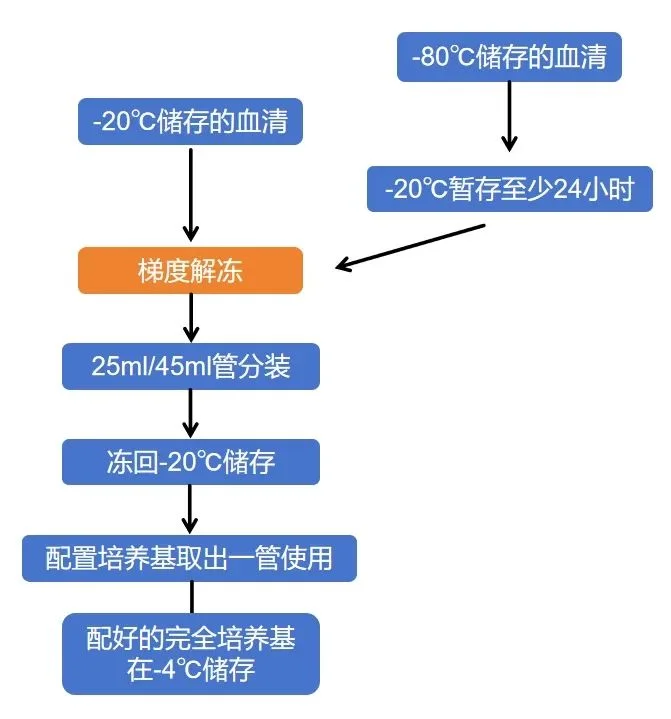
胎牛血清常规储存温度为-20℃,如果想要更加长期保存,可以-80℃保存。解冻的时候不建议直接放在常温中解冻,很容易产生絮状沉淀,进而有可能影响血清品质。建议使用梯度解冻法:
✅第一步:预解冻
◑ 操作:将血清从-80℃冰箱中取出,先转移至-20℃冰箱中放置至少24小时,这一步是为了减小温差,避免直接升温导致的血清成分失活。
◑ 如果没有存储在-80℃中,这步忽略。
✅第二步:过夜溶解:
◑ 操作:将血清从-20℃冰箱中取出,然后置于2-8℃冰箱中过夜溶解
◑ 状态判断:血清呈液态,含有极少量冰晶。
✅第三步:完全液化
◑ 操作:再由4℃转移到室温至全部溶解。
◑ 标志:瓶内液体透光性均匀一致。
针对1000ml大瓶装的特别提醒
◑ 时间要充足:体积越大,热传导越慢,各阶段所需时间相应延长。
◑ 混匀要温和有效:手动摇晃大瓶费力且效果可能不均。如果条件允许,使用瓶架旋转(约10转/分钟)或低速摇床(约50 rpm)更佳。
解冻后处理规范:
◑ 立即分装:按单次用量(如25ml/管、45ml/管)无菌分装,避免反复冻融
◑ 短期存放:4℃保存≤24小时,使用前再次混匀(防成分分层)
◑ 沉淀处理(若产生):400×g离心5分钟取上清,优于过滤法(0.1μm滤膜易阻塞且损失外泌体)
重要避坑点:
1、在解冻的过程中,需要随时轻柔晃动,使血清内成分和温度混合均匀,有助于减少沉淀的产生。
2、解冻后血清配制培养基应72小时内使用,4℃存放超一周易滋生降解酶
3、若血清原存于-80℃,需提前24小时转移至-20℃。跳过此步直接常温会导致:
◑ 温差超60℃,引发脂蛋白不可逆聚集
◑ 沉淀生成风险提高3倍以上
2、血清的用量:并非越多越好
◑ 血清添加量通常在5%、10%、20%之间选择。
◑ 大部分细胞系常规培养使用 10% 的血清浓度。
◑ 某些原代细胞分离或特定实验可能需要 20%。
◑ 具体用量需根据 细胞类型 和 实验目的 进行优化和摸索。
3、胎牛血清什么时候需要热灭活?
热灭活是什么?在细胞培养中,血清常通过56℃加热30分钟灭活补体,以减少对细胞的潜在干扰。
但研究表明,胎牛血清中的补体含量极低,常规热灭活可能破坏生长因子等有益成分,一般来说并不是必要操作。除非一些特定的实验,比如免疫反应实验、病毒实验等。
4、更换血清的正确步骤:梯度更换
养细胞的小伙伴经常会遇到同一个细胞需要更换血清的情况。如果将另一款血清配制的培养基直接用于细胞培养,可能会发现以前增殖很快的细胞突然变慢甚至逐渐脱壁死亡了。这种情况下大概率原因是破坏了细胞的生长环境,细胞出现不适应的情况。通常来说,更换血清的时候我们需要遵循梯度替换,让细胞逐渐适应。具体操作如下:
◑ 首次换液按照新旧血清1:3
◑ 第二次换液新旧血清1:1
◑ 第三次换液新旧血清3:1
◑ 而后完全替换新血清
如果是一些对培养体系较为敏感的细胞,需进一步细化替换比例。
5、血清解冻以后出现了悬浮物是什么?还能继续用吗?
解冻以后如果发现有少量乳白色的絮状或者点状物质,这是为何?可能有以下几个原因:
1、少量脂蛋白变性沉淀;
2、残留的少量血纤维蛋白;
3、血清融解时,冰块和蛋白融化的速度不一样,局部可能因蛋白浓度过高而产生沉淀;
4、整体变质。
以上除了第4点以外,均为正常现象,不会影响血清质量,可用400×g离心5 min取上清,不会对细胞有太大的影响。
如何判断是不是整体变质了呢?首先是絮状沉淀物为少许而非大量,其次是絮状沉淀除外的血清呈现澄清透明淡黄色,而不是混浊。
而对于第1、2点,属于血清本身产品特点、工艺水平等固定因素,基本改变不了;因此,我们能对血清的沉淀物进行有效控制的,往往是基于第3点,也就是说,在融解血清的过程中,应正确解冻,并且减少反复冻融次数。

▲解冻后出现的絮状沉淀
6、使用血清培养细胞以后镜下会动的“小黑点”会是污染吗?
如果您在细胞培养的过程中发现有黑点生成,首先,要肉眼观察培养基是否混浊,黑点是否做不规则游动。如果细胞被污染,微生物则会大量繁殖,培养基就会迅速变黄、变混浊。污染包括细菌污染、支原体污染等。
如果在镜下观察细胞,生长状态良好,与黑点出现前相比,没有任何变化,那么,黑点的出现可能与以下几种情况有关:
(1)细胞生长过程中自然破碎后的细胞残骸;
(2)血清中的杂蛋白,可能是反复冻融的结果;
(3)配制培养基的水质、容器不合格。可应用离心、过滤的方法去除这些黑点;
(4)培养原代细胞中出现小黑点,可能是原代组织中的杂质,多次传代可以消除。
本文来源网络,版权归原作者所有,仅供学习参考,如有侵权请联系删除!









