诺如病毒检测新突破:基于催化发夹组装与CRISPR/Cas12a的双重增强策略
发布时间:2025-08-14 浏览次数:191 分享:
诺如病毒是全球范围内引发食源性疾病的主要病原体之一,每年导致约2.67亿例感染和超过20万例死亡。这种病毒具有高度传染性,尤其在牛奶等食品中容易通过受污染的食品处理者传播。传统的病毒检测方法如逆转录聚合酶链反应(RT-PCR)虽然灵敏度高,但依赖于复杂的设备和繁琐的操作流程,难以满足快速、便捷检测的需求。然而,最近一项发表在《Journal of Dairy Science》上的研究提出了一种基于催化发夹组装(CHA)和CRISPR/Cas12a的双重增强策略,为诺如病毒的超灵敏检测提供了新的解决方案。
创新技术:CHA与CRISPR/Cas12a的完美结合
这项研究的核心在于将催化发夹组装(CHA)和CRISPR/Cas12a技术相结合,形成一种双重信号增强的检测策略。CHA是一种无酶的DNA信号放大技术,通过目标RNA触发的链置换反应,能够高效地将单链DNA或RNA输入转化为大量的双链DNA输出。而CRISPR/Cas12a则以其高灵敏度、特异性和可编程性著称,能够特异性识别并切割目标DNA序列。当两者结合时,CHA产生的大量双链DNA能够被CRISPR/Cas12a精准识别并激活其切割活性,进而切割荧光标记的单链DNA报告分子,产生显著的荧光信号,实现对诺如病毒的超灵敏检测。
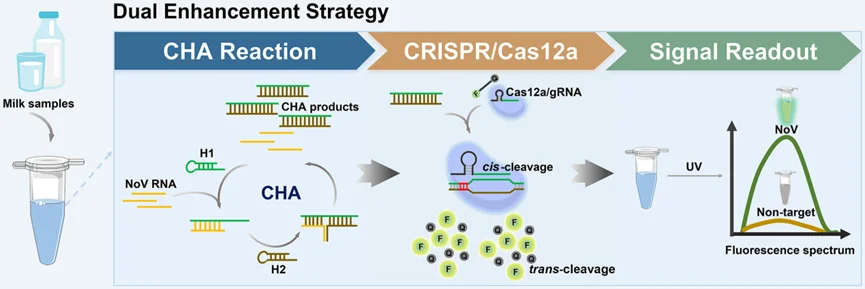
图1 基于催化发夹组装(CHA)和CRISPR/Cas12a的诺如病毒检测双增强策略示意图。H1 =发夹DNA探针1;NoV =诺如病毒。
实验结果表明,这种双重增强策略在检测诺如病毒时表现出了卓越的性能。其检测灵敏度极高,最低检测限可达14飞摩尔(fM),这意味着即使在极低浓度下,也能准确检测到病毒的存在。在特异性方面,该方法能够有效区分诺如病毒与其他常见干扰病毒,如腺病毒、人类肠道病毒和轮状病毒等,显示出良好的抗干扰能力。此外,该检测方法还具有较短的检测时间,整个检测过程仅需
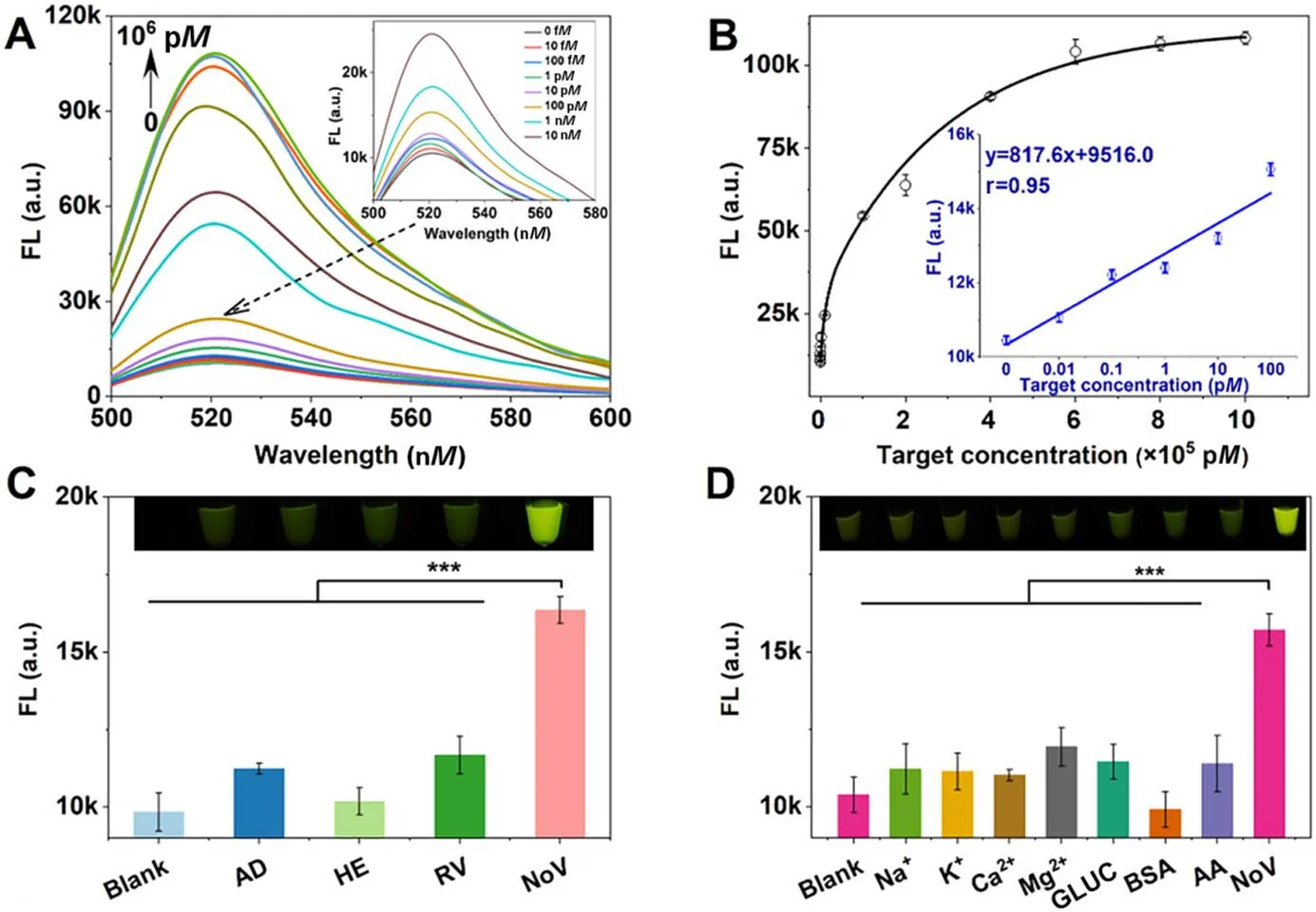
图2 双重增强策略的分析性能。(A)所提出方法在检测不同浓度的目标诺如病毒RNA基因(0-1×106 pM)时的荧光光谱。插图为0至10 nM诺如病毒RNA的荧光光谱。(B)测得的单一荧光强度(FL)与目标浓度之间的相关性。插入部分为FL与0至100 pM目标之间的线性相关性。(C)特异性测试。该方法在检测诺如病毒和非目标肠道病毒时的FL值。(D)抗干扰测试。检测样品中常见干扰物和目标诺如病毒时的荧光强度。插图为相应的反应体系。非目标物的浓度为目标诺如病毒浓度的10倍。统计分析以空白(0 nM诺如病毒RNA)为对照。误差线表示标准差,***P<0.05。AD=腺病毒;a.u.=任意单位;GLUC=葡萄糖;HE=人类肠道病毒;NoV=诺如病毒;RV=轮状病毒。
实际应用:牛奶样本中的成功验证
为了验证该方法在实际食品检测中的应用价值,研究人员将诺如病毒RNA添加到脱脂牛奶样本中进行检测。结果表明,该方法在牛奶样本中的检测回收率在101.689%到104.223%之间,与RT-PCR方法相当,且相对标准偏差(RSD)低于10%,显示出良好的准确性和重复性。这表明该双重增强策略不仅在实验室条件下表现出色,还能够在复杂的食品基质中实现可靠的病毒检测,为食品安全监测提供了一种有力的工具。
表1 牛奶中诺如病毒的回收率分析(±s, n=3)

优势与前景:低成本、高效率的检测方案
与传统的病毒检测方法相比,这种基于CHA和CRISPR/Cas12a的双重增强策略具有显著的优势。首先,它不需要复杂的设备和繁琐的操作流程,大大降低了检测成本和难度,使其更适合在资源有限的环境中使用。其次,该方法的高灵敏度和特异性使其能够快速、准确地检测出病毒,有助于及时发现和控制病毒的传播。此外,该方法的检测成本与商业化的RT-PCR试剂盒相当,但不需要专门的设备,如恒温水浴、金属浴甚至手持设备都可以进行反应。这使得该方法在实际应用中具有广泛的适用性和推广价值。
表2 近期诺如病毒检测方法比较

结论
基于催化发夹组装(CHA)和CRISPR/Cas12a的双重增强策略为诺如病毒的超灵敏检测提供了一种创新的解决方案。该方法不仅具有高灵敏度和特异性,还具有较短的检测时间和较低的检测成本,使其在食品安全监测和公共卫生领域具有广阔的应用前景。随着技术的不断发展和完善,这种双重增强策略有望成为一种标准的病毒检测方法,为保障食品安全和公共健康做出重要贡献。
这种创新的检测方法的出现,不仅为诺如病毒的检测带来了新的希望,也为其他病毒和病原体的检测提供了新的思路和方向。未来,随着更多类似技术的开发和应用,我们有望实现更快速、更准确、更便捷的病原体检测,从而更好地应对各种公共卫生挑战。
参考文献:Shuo Y, Feng X, Zhao C, et al. A dual enhancement strategy for ultrasensitive detection of norovirus based on catalytic hairpin assembly–assisted CRISPR/Cas12a sensing system[J]. Journal of Dairy Science, 2025.
来源:微生物安全与健康网,作者~蔡伟程。





