qPCR的CT值多少标准?到底有没有标准?
发布时间:2025-10-27 浏览次数:261
我们辛辛苦苦做完实验,就是为了得到一串Ct值。但这个数字本身并不能直接告诉你“好”或“坏”,它就像一个“暗号”,只有放在正确的“语境”下解读,才能揭示其背后的生物学意义。今天,我们就把Ct值的“正常范围”这个话题,从里到外一次性说透!
破除执念:qPCR不存在“标准Ct值”
首先要明确一个核心概念:我们无法给所有基因、所有实验都设定一个统一的“标准Ct值”。一个“好”的Ct值,完全取决于你的实验体系和检测目标。
但是,基于无数实验的经验,我们确实可以总结出一个被广泛接受的、可靠的Ct值区间。在这个区间内,你的数据最稳定,定量最准确。
●“黄金”定量区 (Ct: 15 ~ 30)
这是绝大多数实验者追求的“甜区”。落在这个范围内的信号,说明模板量适中,扩增反应处于最稳定、最高效的线性期。你的数据重复性最好,定量结果最可靠。这是一个普遍适用且可信的范围。
●“高表达”警戒区 (Ct: < 15)
Ct值小于15,意味着目标基因的初始模板量极高。这常见于内参基因(如GAPDH, Actin)或过表达实验。
这不是“不好”,而是需要“警惕”。过低的Ct值可能意味着荧光信号过早进入平台期,甚至超出了仪器的线性检测范围,这反而会影响定量的准确性。如果你的目的基因Ct值都小于15,或许应该考虑适当稀释一下你的模板。
●“低表达”慎用区 (Ct: 30 ~ 35)
这个区间的信号说明目标基因的表达水平很低。结果仍然可以被认为是“阳性”的,但已经进入了随机性(Stochastic effect)容易出现的区域。此时,微小的加样误差都可能导致Ct值产生较大波动,重复性会变差。
●“不可信”报告区 (Ct: > 35)
当Ct值大于35,实验的“警报”就响了。因为如此微弱的信号,很难区分是真实的极低表达,还是由引物二聚体、非特异性扩增等造成的背景噪音。此时,你必须结合溶解曲线(Melt Curve)来判断:如果溶解曲线是漂亮的单峰,且与阳性对照一致,那么这可能是一个真实但极弱的信号;如果出现杂峰,那这个Ct值基本可以判定为假阳性,没有意义。
脱离Ct值看重复性,都是“耍流氓”
一个孤零零的Ct值毫无意义,重复性才是衡量你实验稳不稳的“金标准”。
我们通常会设置3个技术重复(technical replicates),即用同一份样品做的3个平行反应。理想情况下,它们的Ct值应该高度一致。
●“优秀”标准:ΔCt < 0.5
这是大部分实验者追求的目标。 副孔间差距0.5内,这表明你的移液操作非常精准,体系稳定,结果高度可信。
●“可接受”标准:0.5 < ΔCt < 1.0
如果复孔之间的差异不超过1,结果通常可以接受,但也提示你在加样操作上还有优化的空间。
●“不可靠”标准:ΔCt > 1.0
如果重复孔之间的Ct值差异超过1,意味着数据波动巨大,这通常指向了严重的随机误差或操作失误(如加样不准、气泡、管盖没盖严等)。这样的数据应果断舍弃,并查找原因。
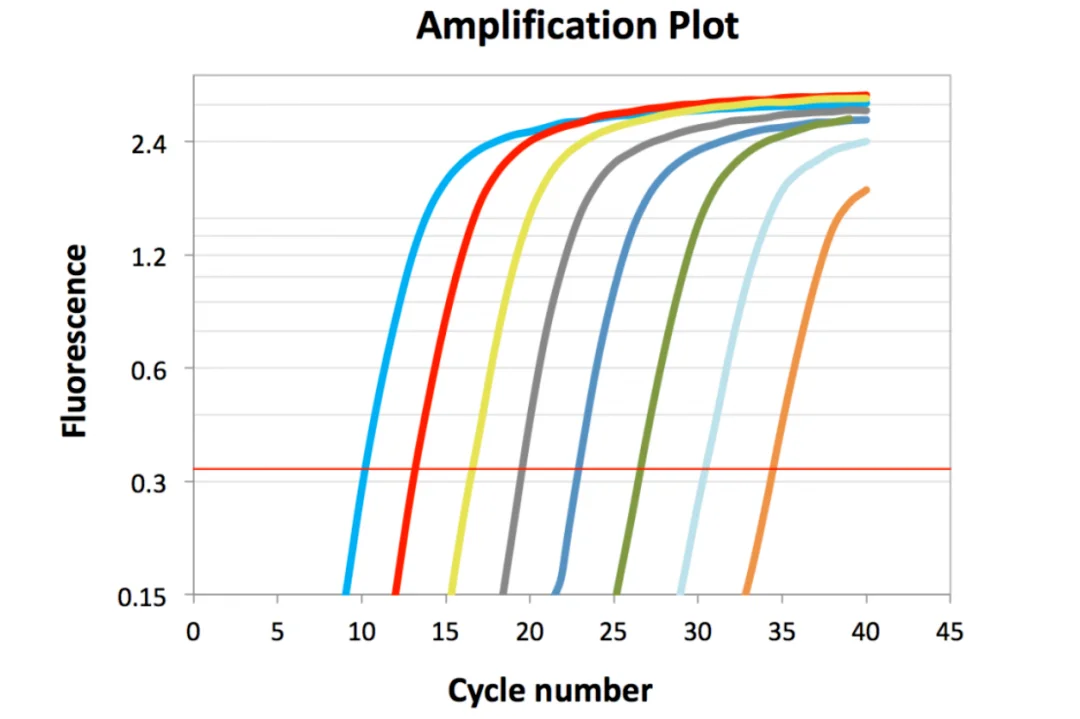
情景决定意义:我的Ct=33,到底能不能用?
回到最初的问题,我们来做个情景分析:
情景A:你检测的是一个高表达的管家基因,Ct值却是33。
解读:实验大概率出问题了。可能是RNA提取质量差、反转录效率低,或是qPCR体系被抑制。
情景B:你检测的是一个文献报道的低丰度lncRNA,Ct值是33,重复孔差异小于0.5,且溶解曲线是完美的单峰,NTC(无模板对照)无起峰。
解读:恭喜你,这很可能是一个真实、可信的结果!它准确地反映了这个基因的低表达特性。
小结
别再问“Ct值多少算正常”,要问你的Ct值是否落在15-30的黄金定量区间。
Ct值过高 (>35) 或过低 (<15) 都是警报,需要结合模板浓度和实验目的综合判断。
重复性比绝对值更重要:技术重复孔间的ΔCt应小于0.5,最大不宜超过1。
永远结合溶解曲线和阴性对照(NTC),这是判断Ct值真伪的最后防线。
理解了这几点,你才算真正跨入了qPCR定量分析的大门。你的Ct值,从此不再是让你焦虑的数字,而是你手中解读生物学奥秘的钥匙。
本文由环凯转载自“誉嘉医学”公众号,版权归原作者所有,仅供学习参考,如有侵权请联系删除!





