干货速看!细胞培养污染防控全指南
发布时间:2025-10-28 浏览次数:88
细胞培养是生物制药、细胞治疗、基础科研等领域的核心技术支撑,其质量直接决定实验结论的可靠性、药品生产的安全性与细胞治疗的临床效果。在细胞体外培养过程中,污染是从业者常面临的 “棘手障碍”—— 它会悄然侵入培养体系,破坏细胞生长环境,导致细胞形态异常、代谢紊乱。
本篇系统梳理了三大污染源——支原体、细菌、真菌的生物学特性、污染典型表现、精准检测方法、科学清除策略,为细胞培养质量管控提供全面参考。
三大污染源——支原体、细菌与真菌
要实现污染的有效防控,首先需明确三大污染物的生物学本质。三者因分类地位、结构组成及代谢特性差异,在细胞培养体系中的滋生能力与污染风险各不相同:
支原体污染
支原体(Mycoplasma,又称霉形体)属于柔膜体纲(Mollicutes),是目前已知最小的原核生物之一,结构仅由脂蛋白膜、核糖体和圆形双链 DNA 组成(无细胞壁),基因组大小为 580-2,200 kb,生物合成能力有限(如无法自主合成胆固醇),需依赖外源营养补充。
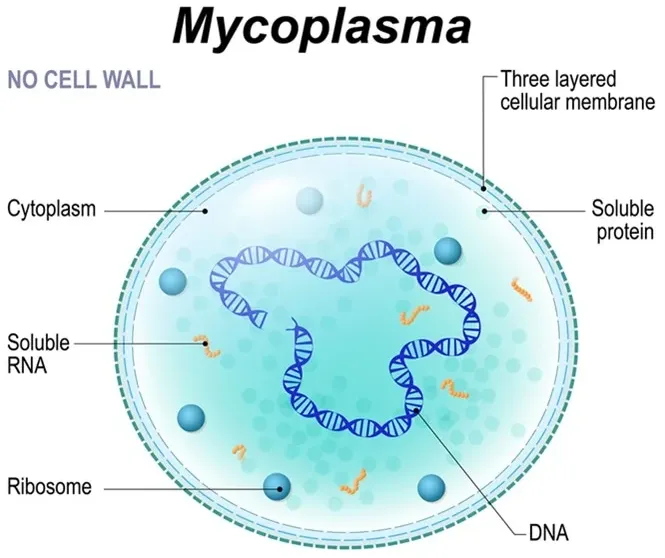
细菌污染
细菌(Bacteria)属于细菌域,是单细胞原核生物,主要类群包括厚壁菌门、变形菌门等,结构含细胞壁(肽聚糖构成,革兰氏阳性菌壁厚、阴性菌壁薄且含脂多糖)、细胞膜、拟核(环状双链 DNA),部分有鞭毛或荚膜,基因组大小 1-10 Mb,营养需求因种类而异,部分需外源提供维生素、氨基酸等生长因子。
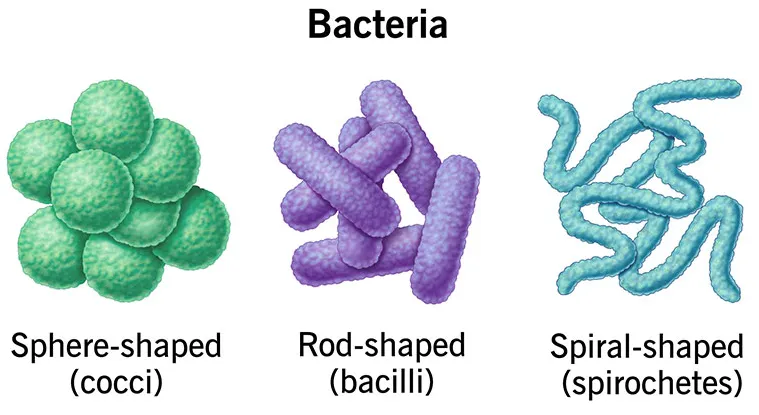
真菌污染
真菌(Fungi)属于真菌界,是真核微生物,分酵母型(单细胞)和霉菌型(多细胞,形成菌丝体),结构有完整细胞核(含线性染色体)、线粒体等细胞器及几丁质细胞壁,基因组大小 8-100 Mb,无法自主合成全部有机营养,需外源碳源(如葡萄糖)、氮源(如氨基酸)。
常见细胞培养基中的葡萄糖、谷氨酰胺、血清等成分,能满足支原体、细菌、真菌对营养的依赖,且 37℃恒温、适宜湿度的培养环境,为三者繁殖提供了理想条件;同时,支原体因无细胞壁、体积微小,易通过常规 0.22 μm 滤膜污染培养基,且对多种抗生素耐药;细菌繁殖速度快(代时20-60分钟),可通过污染的耗材(如未彻底灭菌的吸头)或不规范操作(如手部未消毒)进入体系,部分还能形成生物膜增强耐药性;真菌的孢子耐干燥、耐高温,可随气流扩散至培养瓶,且部分菌株(如白色念珠菌)对常用抗真菌药耐药,这些特性共同导致三者易在细胞培养中滋生并引发污染。
污染的典型表现
明确三大污染物的生物学特性后,掌握其在细胞培养中的典型表现,是实现 “早发现、早判断” 的关键。三类污染对细胞状态、培养基环境的影响存在显著差异,具体表现如下:
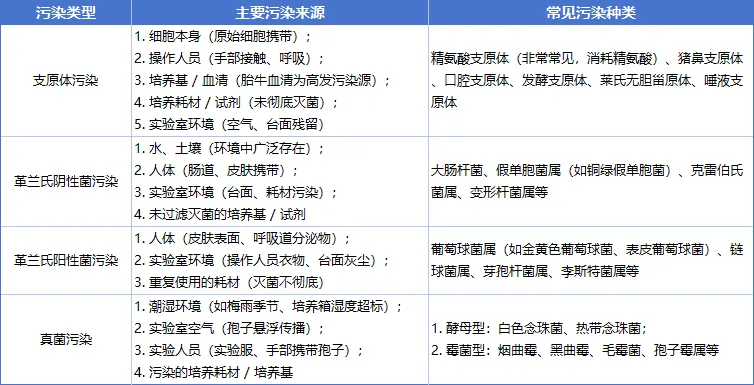
支原体污染
1
细胞生长停滞,贴壁细胞易脱落,染色体数目或结构异常。
2
细胞代谢通路紊乱,精氨酸消耗快,胞质出现细小空泡。
3
细胞膜抗原性改变,黏附能力下降,细胞功能活性降低。
4
支原体无细胞壁(0.1-0.3μm),普通光镜难识别,对青霉素耐药。
5
细胞复苏后存活率低,培养基无浑浊,隐性污染易被忽视。
细菌污染
1
培养基数小时内浑浊(菌种不同形态 / 颜色异常),pH 骤降。
2
细胞 1-2 天内大量死亡,贴壁细胞皱缩、悬浮细胞聚团破裂。
3
细菌产毒素破坏细胞膜,细胞内容物泄漏,细胞器溶解。
4
细菌快速耗尽培养基营养,细胞凋亡信号通路被激活。
5
细菌体积大,100-200 倍光镜易观察,繁殖扩散极快。
真菌污染
1
酵母型初期见细小乳白菌落,后期增多致细胞空泡化。
2
霉菌型先出纤细菌丝,后成绒毛 / 团状菌落,缠绕细胞。
3
细胞伸展不良、活性降低,核固缩、染色质边缘化。
4
真菌孢子耐高低温干燥,随气流扩散,致交叉污染。
5
霉菌产毒素损伤细胞 DNA,常规消毒难清除孢子。
传统检测法vsqPCR检测法
传统检测法
培养法作为《中国药典》推荐的金标准,对支原体通过观察 “煎蛋状” 菌落、细菌通过营养培养基上的特征菌落(如金黄色葡萄球菌的圆形金黄色菌落)、真菌通过沙氏培养基上的菌丝 / 孢子型菌落(如白色念珠菌的乳白色光滑菌落)进行鉴定,具有 “能确认活微生物污染” 的优势。但实际应用中存在共性局限性:
1
周期冗长:支原体需 7-14 天,细菌需 24-48 小时,真菌需 2-5 天,难以匹配生物制药、细胞治疗等领域 “快速排查” 的需求。
2
操作繁琐:需严格控制不同微生物的培养条件(如支原体对精氨酸 / 葡萄糖的依赖、真菌对沙氏培养基的特殊需求),且易受杂菌干扰。
qPCR检测法
近年来,以 qPCR 法(实时荧光定量聚合酶链式反应)为代表的快速检测技术实现突破。该技术基于传统 PCR 发展而来,通过在反应体系中加入荧光基团(如 SYBR Green 染料、TaqMan 探针),实时监测荧光信号累积,结合标准曲线完成未知模板分析。相较于培养法,qPCR 法优势显著:
1
检测速度快(2-4 小时完成),满足紧急排查需求
2
灵敏度高,检测下限低
3
特异性强(通过特异性引物 / 探针设计),避免细胞核酸或杂菌干扰
目前,qPCR 法已被广泛应用于生物制药、细胞治疗、科研实验室等场景,且得到行业标准认可 ——2025版中国药典新修订的《9201药品微生物检验替代方法验证指导原则》明确赋予三类技术法定地位:核酸扩增技术(如实时定量PCR)、基因指纹分析(如毛细管电泳)、全基因组测序技术(如NGS)。尤其适用于临床级细胞产品、疫苗生产等对检测时效与准确性要求高的领域。

污染清除方法
由于支原体、细菌、真菌的生物学特性(如有无细胞壁、繁殖速度、耐药性)差异显著,污染清除需遵循 “针对性选法、分级处理、兼顾细胞安全” 原则,具体方法如下:
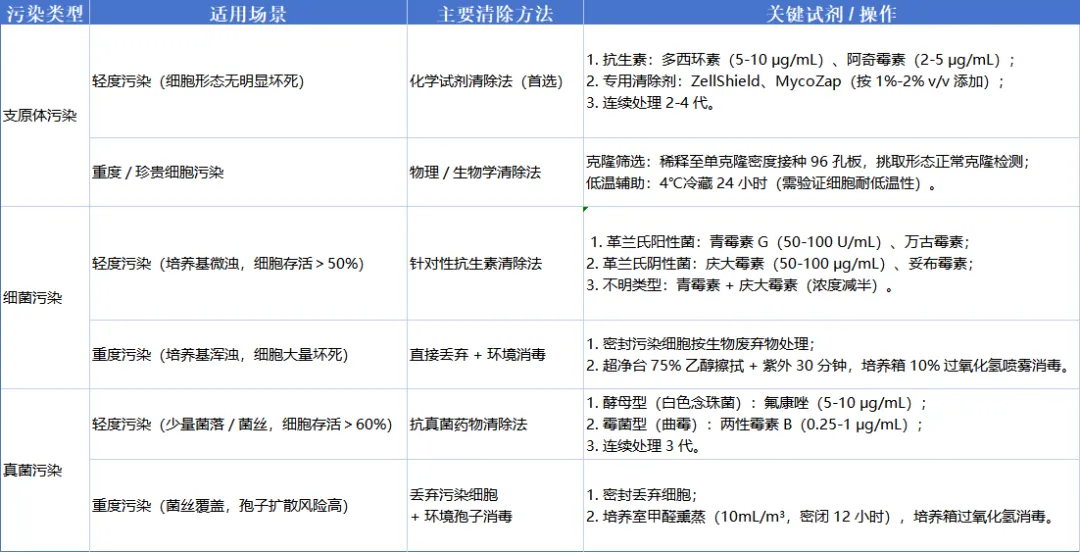
共性注意事项:
1
先检测后清除:优先通过 qPCR 等方法确认污染类型,避免盲目用药;
2
优先保护细胞:所有清除试剂需做细胞毒性预实验,选择无毒性的有效浓度;
3
避免耐药性:单一药物连续使用不超过 4 代,可交替使用不同机制试剂;
4
彻底消毒环境:清除细胞污染的同时,同步消毒培养箱、超净台等,防止交叉污染;
5
重度污染优先丢弃:若细胞大量坏死或污染扩散风险高,直接丢弃以避免更大损失。
本文由环凯转载自“YOCON友康生物”公众号,版权归原作者所有,仅供学习参考,如有侵权请联系删除!









