细胞冻存技术原理与标准化操作流程
发布时间:2025-11-17 浏览次数:63
细胞冻存是细胞生物学研究中的核心实验技术,通过低温保护剂和程序性降温过程,实现细胞系的长期保存。该技术的关键在于控制冰晶形成速度,最大限度地维持细胞膜完整性和生物活性。
一、技术原理
细胞冻存利用二甲基亚砜(DMSO)等低温保护剂渗透细胞膜,降低细胞内水分的冰点,减缓冰晶形成速率。程序性降温过程确保细胞在-20℃至-60℃温度区间平稳通过最大冰晶形成带,避免细胞内冰晶对细胞器造成机械损伤。
二、实验材料准备
1、胰蛋白酶消化液(0.25%);
2、细胞冻存液配方:胎牛血清与DMSO按9:1体积比混合;
3、无菌离心管、冻存管及移液系统;
4、程序降温盒或可控速率降温装置。
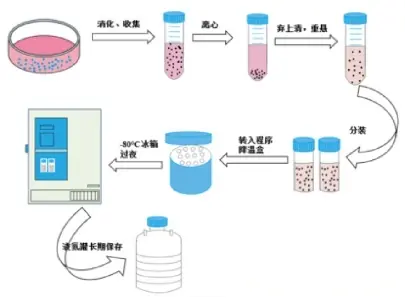
三、标准化操作流程
1、选择对数生长期细胞(培养容器底面积80%覆盖率);
2、去除原培养基,加入胰蛋白酶溶液洗涤细胞;
3、重新加入胰蛋白酶,37℃消化至细胞形态变圆;
4、加入含血清培养基终止消化反应,轻柔吹打获得单细胞悬液;
5、800rpm离心5分钟收集细胞;
6、吸去离心管中液体,去除残余胰蛋白酶;
7、重悬细胞于预冷冻存液(细胞密度建议1×10^6/ml),分装至冻存管(每管1-1.5ml);
8、实施程序降温:4℃平衡30分钟 → -20℃维持2小时 → -70℃过夜;
9、最终转移至液氮长期保存。
四、质量控制标准
成功的细胞冻存应满足:
1、复苏后细胞贴壁率≥95%;
2、维持原有细胞形态特征;
3、复苏后24小时内恢复增殖能力;
4、无微生物污染迹象。
五、关键技术参数
1、DMSO终浓度严格控制在10%(v/v);
2、降温速率维持在-1℃/分钟至-80℃;
3、冻存细胞应处于对数生长期;
4、所有操作遵循无菌规范。
六、技术优化要点
1、冻存前24小时更换培养基确保细胞最佳状态;
2、根据不同细胞类型调整冻存密度:
(1)快速增殖细胞:单层培养面积长满一个25cm培养瓶/支;
(2)慢速增殖细胞:单层培养面积长满两个25cm培养瓶/支;
3、短期保存(≤3个月)可置于-70℃,长期保存需使用液氮。
七、特殊细胞处理
悬浮细胞冻存可省略消化步骤,直接离心收集。原代细胞冻存效果需根据细胞特性具体优化。所有试剂使用前应平衡至室温或37℃以减少温度应激。

细胞冻存技术的标准化实施对保证实验数据的可重复性和细胞资源的可持续利用具有重要作用。规范化的操作流程和严格的质量控制是维持细胞遗传稳定性和功能完整性的关键保障。
本文由环凯转载自“细胞实验助手”公众号,版权归原作者所有,仅供学习参考,如有侵权请联系删除!








