一种检测阪崎肠杆菌的“一混即读”策略
发布时间:2024-11-08 浏览次数:549
食品中致病菌的快速检测是保障食品安全的关键,尤其是在婴幼儿配方奶粉中常见的阪崎肠杆菌(Cronobacter sakazakii)。传统检测方法如培养法耗时长,难以满足快速检测需求。本文提出了一种基于纳米抗体(nanobody)诱导金纳米粒子(AuNPs)聚集的比色传感器,通过“一混即读”的方法实现对阪崎肠杆菌的快速检测。
1. 纳米抗体诱导金纳米粒子聚集的机制
纳米抗体具有优异的生化特性,可特异性识别细菌表面抗原,并导致AuNPs聚集。在加入阪崎肠杆菌后,纳米抗体与细菌结合,空间位阻抑制AuNPs进一步聚集,从而产生颜色变化,使溶液从蓝色恢复为红色(图1)。这一现象为“一混即读”检测提供了简单而灵敏的比色信号。
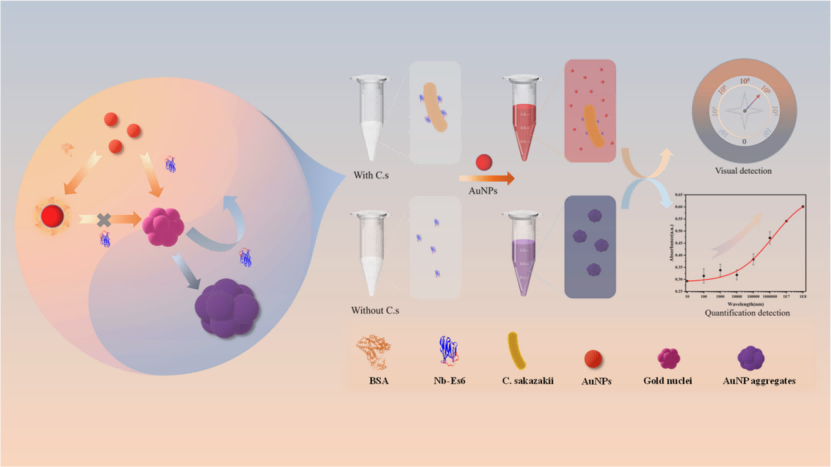
图1. 基于纳米体诱导AuNPs聚集的阪崎梭菌“混合-读取”比色免疫传感器的制备。
图2展示了纳米体诱导AuNPs聚集的表征。图2A显示在目标细菌存在或不存在的情况下,纳米体对AuNPs聚集的影响示意图。2B为AuNPs溶液的紫外-可见吸收光谱,AuNPs溶液与含和不含坂崎菌的纳米体溶液混合。不同条件下添加Nb−Es6 (E−H) TEM图像前后AuNPs的粒径(C)和zeta电位(D)的变化。(E) AuNPs溶液的TEM图像。2F仅Nb−Es6存在时AuNPs溶液的TEM图像。(G) Nb−Es6和C. sakazakii存在下AuNPs溶液的TEM图像。2H为AuNPs溶液的TEM图像。
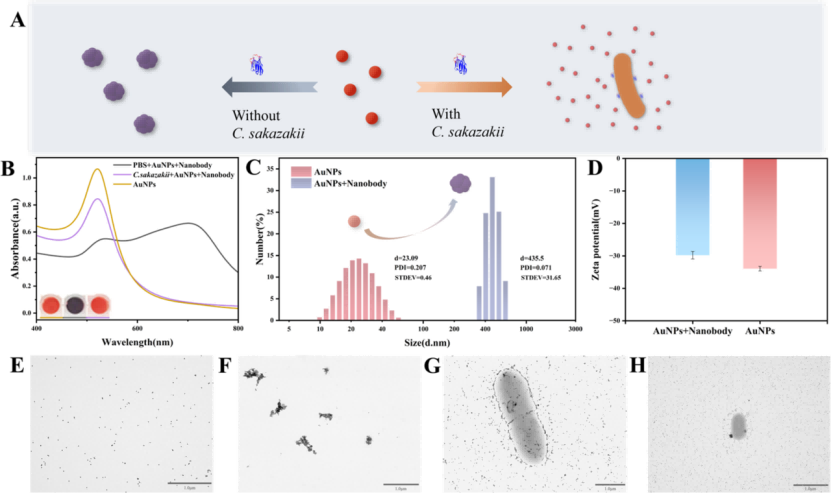
图2. 纳米体诱导AuNPs聚集的表征。
此外,为了确定纳米体诱导的聚集是否是一种普遍现象,我们测试了7种类型的纳米体,发现它们都能诱导AuNPs的聚集(图3A)。并进一步阐明纳米体诱导柠檬酸盐覆盖的AuNPs聚集的机制,发现柠檬酸盐覆盖的AuNPs在pH值6 ~ 10范围内保持稳定(图3B)。在纳米体存在的情况下,在pH值为6−10的范围内,柠檬酸覆盖的AuNPs的颜色和光谱发生了显著变化。如图3C所示,当pH值低于纳米体的等电点(pI)时(pH值为6.93)(图3D),由于带正电的纳米体和带负电的柠檬酸盐覆盖的AuNPs之间存在强大的静电引力,柠檬酸盐覆盖的AuNPs会发生严重的聚集和沉淀。在纳米体的pI附近,由于纳米体的正电荷逐渐减少,柠檬酸盐覆盖的AuNPs的聚集程度受到抑制。此外,当pH值超过pI时,纳米体和柠檬酸覆盖的AuNPs都携带负电荷,但柠檬酸覆盖的AuNPs聚集持续存在。因此,这表明纳米体诱导的柠檬酸盐端金纳米颗粒聚集不仅仅涉及简单的静电吸引。为了验证不同溶剂对聚集效应的影响,研究人员首先在150 μL的AuNPs中加入10 μL PBS、纯净水和纳米体(3 μg/mL),并在5 min后用紫外可见分光光度法测量吸光度峰。研究结果显示,只有纳米体显著改变了AuNPs的吸光度峰,并伴有颜色从红色到蓝色的变化(图3E)。接着继续探索了AuNPs与其他生物分子(包括血清蛋白和脱脂奶粉)的相互作用。作为对照,将10 μL 30 μmL纳米体加入150 μL与10 μL不同浓度(3、30、300、3000 μg/mL)的BSA预混的AuNPs溶液中,观察到当BSA浓度低于300 μg/mL时,AuNPs溶液中有明显的聚集现象。然而,随着浓度的继续增加,聚集作用明显减弱,几乎没有观察到聚集,AuNPs溶液呈现酒红色(图3F)。一种可能的解释是,一些蛋白质可以通过在AuNPs表面形成稳定的蛋白质冠状体来阻碍纳米体诱导的AuNPs聚集(图3G)。为了进一步了解纳米体诱导AuNPs聚集的过程,我们在4种AuNPs溶液中分别加入4 μL 30 μg/mL的纳米体,每3分钟在一个孔中加入10 μL 3000 μg/mL的BSA。紫外-可见光谱结果显示,加入BSA后,AuNPs溶液的状态迅速稳定,阻止了进一步的聚集(图2H)。这一观察结果强调了纳米体诱导AuNPs聚集的渐进性质。此外,发现不同浓度的纳米体会影响AuNPs的聚集动力学。AuNPs -纳米体复合物的红外光谱显示出酰胺I波段峰的变化,从1625到1631 cm−1(图2I)。酰胺I带的这些变化表明,观察到的这些蛋白质的构象改变是它们与AuNPs相互作用的结果,对应于C=O拉伸。
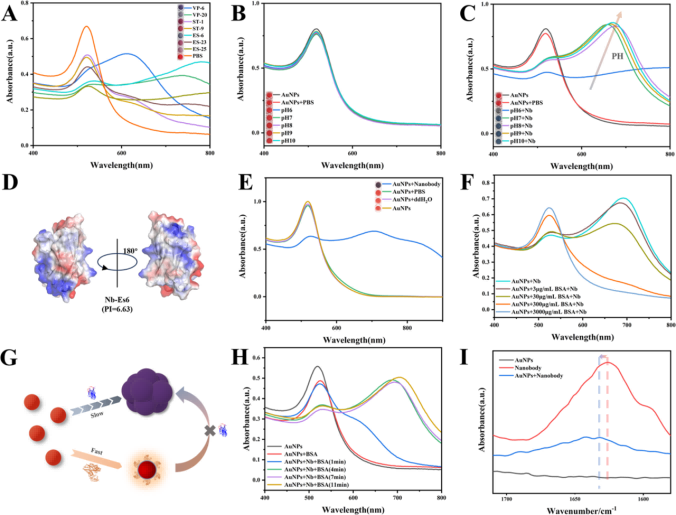
图3. 纳米体诱导AuNPs聚集的原理分析。
2. 高灵敏度与特异性
基于上述分析,柠檬酸末端金纳米颗粒在水中分散良好,使溶液呈现红色。在纳米体存在的情况下,柠檬酸终止的金纳米颗粒被诱导聚集,导致颜色从红色变为蓝色。然而,当纳米体与不同浓度的阪坂曲菌结合时,由于细菌细胞的微米尺度,AuNPs保持自由分散,因此520 nm处的紫外吸收峰随着细菌浓度的降低而逐渐降低(图4B)。实验表明,该检测方法肉眼可见的检测限为103 CFU/mL,定量检测限可达136 CFU/mL(图4E)。
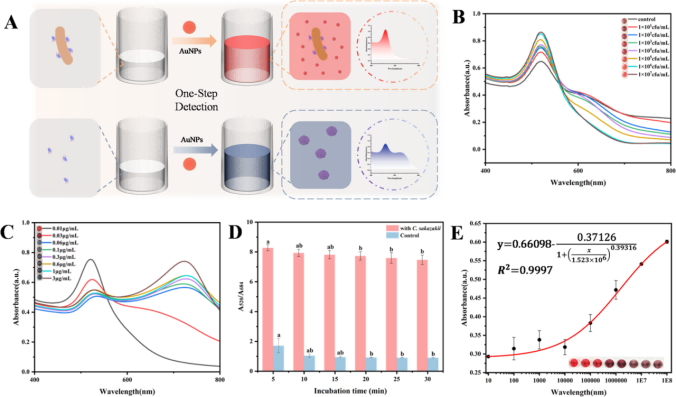
图4. “混合-读取”比色免疫传感器检测性能评价。
平台在20分钟内完成检测,且对其他细菌(如大肠杆菌、沙门氏菌等)无交叉反应,表现出良好的特异性,适用于复杂样本(图5)。
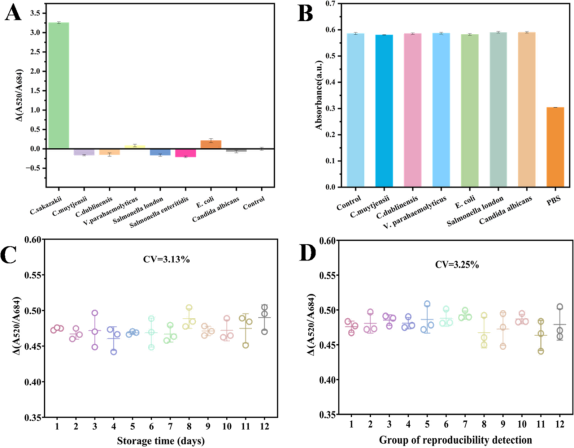
图5. 特异性及稳定性评估。
3. 在实际样本中的应用
该比色传感器成功应用于婴儿配方奶粉的阪崎肠杆菌检测,实验获得的检测回收率在80.3%至89.9%之间,证实了方法在复杂食品基质中的可靠性和实用性。
总结:基于纳米抗体诱导的AuNPs聚集技术,为快速、无标记、经济的致病菌检测提供了创新手段。该“一混即读”平台具备广阔的食品安全检测应用潜力,特别适合用于便携式现场检测。
参考文献:Chen, Pengyu, et al. "Nanobody-Induced Aggregation of Gold Nanoparticles: A Mix-and-Read Strategy for the Rapid Detection of Cronobacter sakazakii." Analytical Chemistry (2024).
来源:微生物安全与健康网,作者~高宝





