无扩增快速检测:纸基酸性脱氧核酶装置高灵敏度识别大肠杆菌
发布时间:2024-10-17 浏览次数:717
大肠杆菌(Escherichia coli, E. coli)是导致75%尿路感染的元凶,包括膀胱炎和急性肾盂肾炎,这是一种常见的细菌感染性疾病,对公共健康构成威胁。早期准确检测大肠杆菌对于控制病程和改善患者治疗至关重要。这需要一种具有高灵敏度和特异性的检测方法,以应对疾病早期阶段靶标的低丰度。尽管聚合酶链反应(polymerase chain reaction, PCR)作为病原体检测的金标准满足这些要求,但其缺点如操作复杂和仪器昂贵,限制了其在资源匮乏地区的初步诊断应用。
即时检测(point of care testing, POCT)由于其便携性、一次性、设置简便以及操作简单,已成为实验室外诊断检测的重要工具。纸基设备是POCT的理想候选者,因为它们具有轻便、一次性、兼容性和低成本等特性。迄今为止,各种纸基POCT设备已经广泛用于检测病原菌,如幽门螺杆菌、金黄色葡萄球菌、伤寒沙门氏菌、嗜酸乳杆菌等。其中,最流行的纸基设备是比色检测,这种方法可以实现快速且可视化的POCT。然而,这些设备通常面临灵敏度不足的问题。引入信号放大策略是提高灵敏度的常用方法,然而,这增加了成本并延长了分析时间。因此,开发一种无需扩增的、能够快速且高度灵敏地检测大肠杆菌的纸基POCT设备是非常必要的。
裂解RNA的DNA酶(RNA-cleaving DNAzymem, RCD)是一种经典的DNA催化剂,能够进行目标响应的RNA底物裂解。大多数通过体外选择获得的细菌特异性RCD需要二价金属离子的辅助,在中性pH条件下裂解RNA/DNA嵌合底物。这可能导致外源核酸酶的非特异性降解,从而产生假阳性结果
近日,大连理工大学环境学院Meng Liu团队在Chem Comm期刊上发表了题为:Amplification-free detection of Escherichia coli using an acidic deoxyribozyme-based paper device论文。

为了解决该问题,开发了一种由大肠杆菌激活的酸性RCD(acidic RCD, aRCD-EC1),该酶只需要一价金属离子作为辅因子,并且在pH值为5.3的条件下表现出更高的催化活性。aRCD-EC1能够在10 min内检测到低至104 CFU/mL的大肠杆菌。先前研究表明,辣根过氧化物酶(horseradish peroxidase, HRP)通常用于比色反应,并且在酸性条件下表现出最佳的催化性能。基于上述结果,开发一种与HRP连接的aRCD-EC1检测方法,可能实现无扩增条件下的大肠杆菌的高灵敏度检测。
工作原理如图1所示。aRCD-EC1在5'端被修饰有DNA延伸序列,用于与HRP标记的DNA探针进行杂交,并在3'端与生物素修饰,以通过链霉亲和素–生物素相互作用固定在琼脂糖珠子上。在大肠杆菌存在的情况下,MaRCD-EC1可以被激活,催化形成的HRP@MaRCD-EC1/珠子的裂解。随后,释放的包含HRP的DNA探针可以分离出来,用于在酸性条件下进行H₂O₂介导的3,3',5,5'-四甲基联苯胺(3,3’,5,5’-tetramethylbenzidine, TMB)的氧化反应,生成蓝色产物。因此,大肠杆菌的检测可以通过检测HRP的释放来实现。
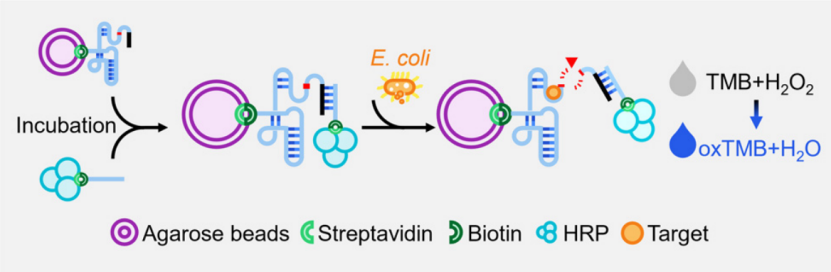
图1 用于大肠杆菌视觉检测的HRP@MaRCD-EC1/beads示意图。
我们首先采用dPAGE分析在pH5.3条件下测试了MaRCD-EC1的裂解活性(图2a)。在大肠杆菌粗细胞内混合物(crude intracellular mixture derived from E. coli, CIM-EC)存在的情况下,MaRCD-EC1表现出表观速率常数(kobs)为0.11 min⁻¹,低于aRCD-EC1的kobs(1.18 min⁻¹),30 min后在25°C下的裂解产率为89.2%(图2b)。随后,我们测试了MaRCD-EC1对非特异性病原体的CIM反应,包括肺炎克雷伯氏菌(K. pneumoniae)、金黄色葡萄球菌(S. aureus)、铜绿假单胞菌(P. aeruginosa)、角膜炎假单胞菌(B. gladioli)、蜡状芽孢杆菌(B. cereus)和枯草芽孢杆菌(B. subtilis)。未观察到裂解产物,表明MaRCD-EC1具有高度特异性(图2c)。通过加入不同浓度的CIM-EC研究其灵敏度。结果显示,MaRCD-EC1可以在30 min内检测到低至102 CFU/mL的E. coli,展示了其高灵敏度。显然,RCD-EC1 3'端的生物素修饰仅延长了分析时间,对MaRCD-EC1的选择性和灵敏度几乎没有影响。综上所述,这些结果为开发用于大肠杆菌检测的高灵敏度比色探针奠定了基础。

图2 (a) MaRCDs的工作原理是通过与CIM-EC中的目标结合激活,不依赖M²⁺离子。F表示荧光素标记的dT,R表示腺苷核糖核苷酸。(b) MaRCD-EC1S在25°C下对CIM-EC的动力学响应,图中给出了kobs值。(c) MaRCD-EC1对来自不同细菌的CIM的响应,包括克雷伯氏肺炎菌(KP)、金黄色葡萄球菌(SA)、铜绿假单胞菌(PA)、角膜炎假单胞菌(BG)、蜡样芽孢杆菌(BC)、枯草芽孢杆菌(BS)和大肠杆菌(EC)。M =marker,Unclv =未裂解,Clv =已裂解,NC =阴性对照,%Clv = 裂解百分比,计算公式为:%Clv = (clv × 100) / (clv + unclv),其中clv为已裂解条带的体积,unclv为未裂解条带的体积。(d) 在25°C下反应30 min后,10% dPAGE分析MaRCD-EC1对从10–10⁷ CFU/mL大肠杆菌细胞制备的CIM-EC的响应。
我们接着研究了HRP在不同pH值下的催化活性。如图3a所示,HRP在弱酸性环境(pH 5-6)中表现出最高的活性,这与MaRCD-EC1裂解缓冲液相容。通过简单的离心将释放的HRP从琼脂糖珠中分离出来,并向上清液中加入TMB和H₂O₂混合物进行比色测定。根据比色反应的kobs与HRP浓度之间的线性关系,可以计算出不同反应时间下释放的HRP比例。在CIM-EC存在的情况下,随着MaRCD-EC1裂解反应时间的增加,释放的HRP量逐渐增加,并在30 min内达到平台期(图3b)。相反,在没有CIM-EC的情况下,没有观察到HRP的释放。
研究人员还研究了基于HRP@MaRCD-EC1/珠子的生物传感器的传感性能。如图3c、e所示,当测试来自克雷伯氏肺炎菌、金黄色葡萄球菌、铜绿假单胞菌、角膜炎假单胞菌、蜡样芽孢杆菌和枯草芽孢杆菌的CIM时,未观察到明显的比色信号。通过使用不同浓度的大肠杆菌(10–107 CFU/mL)制备的CIM对比色法的灵敏度进行了测试。结果表明,该方法可以检测到低至102 CFU/mL的大肠杆菌(图3d)。比色信号强度与大肠杆菌浓度相关,使其能够实现半定量的比色检测。综上所述,这些结果表明,将HRP@MaRCD-EC1固定在琼脂糖珠上对传感性能几乎没有影响。
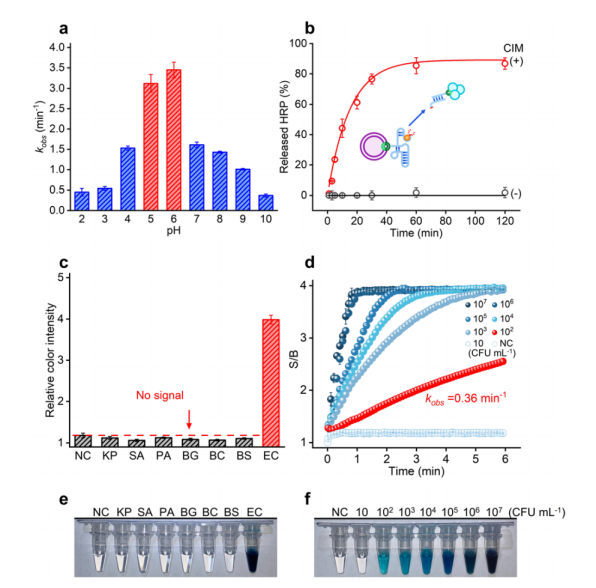
图3 (a) 不同pH值下HRP的催化活性。(b) 在没有和存在CIM-EC的情况下珠子中HRP的动力学释放。(c) 在不同细菌存在下的相对颜色强度分析。相对颜色强度表示为 I/I0,其中I是t = 6 min时的颜色强度,I0是存在CIM-EC时的颜色强度。(d) 在不同浓度的CIM-EC存在和不存在的情况下HRP的释放动力学。S/B = 信号与背景比。(e) 在不同细菌CIM存在下HRP@MaRCD-EC1-珠子溶液的上清液图像。(f) 在不同浓度的CIM-EC下HRP@MaRCD-EC1-珠子溶液的上清液图像。
在将琼脂糖珠通过pullulan固定在纸张表面后,我们开发了一种基于HRP@MaRCD-EC1的纸基传感器,用于大肠杆菌的比色检测。该纸基传感器具有三个区域(图4a):左侧的传感区(Z1)包含用于靶标识别的HRP@MaRCD-EC1,中间区域(Z2)覆盖有5%(w/v)的pullulan薄膜,用于控制液体的流速,右侧检测区(Z3)含有用于信号输出的TMB。这三个区域通过蜡屏障印制在背衬为塑料的Whatman滤纸(1号)上。操作步骤如下:在典型测试中,将50 µL的CIM-EC加入Z1进行靶标识别,并裂解RNA底物以释放HRP。经过30 min的反应,Z2处的pullulan薄膜会溶解,允许溶液流向Z3。由于琼脂糖珠的平均直径为100 µm,明显大于Whatman滤纸的平均孔径(11 µm),因此琼脂糖珠无法通过毛细力驱动流动,只有释放的HRP可以流向Z3,在H₂O₂的存在下氧化TMB,从而产生比色信号。
我们首先通过该纸基设备对大肠杆菌进行了可视化检测,并验证了其可行性。在HRP、MaRCD-EC1和CIM-EC的存在下,生成了颜色信号。结果表明,装置上的HRP@MaRCD-EC1/珠子能够特异性识别大肠杆菌并释放HRP以进行比色反应。随后,利用不同来源的CIM评估了装置的特异性,未观察到颜色信号(图4b),表明其特异性较高。此外,我们发现颜色强度与大肠杆菌的浓度呈正相关,范围从102到107 CFU/mL(图4c)。在30 min内,该设备实现了102 CFU/mL的检测限。值得注意的是,与未采用扩增过程的报道纸基设备相比,该设备提供了更高的灵敏度(检测限为102 CFU/mL)和更短的样品处理时间(30 min)。
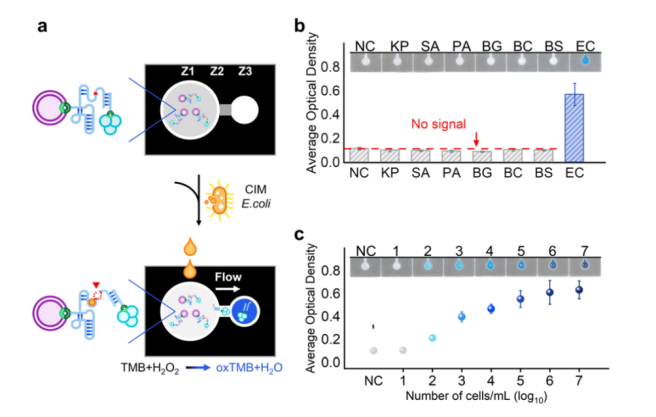
图4 (a) 纸基装置的设计及其工作原理。Z1为感应区,Z2为阀门区,Z3为检测区。(b) 纸基装置对不同细菌反应的平均光密度值。插图:在添加图中指示的细菌后,Z3区域的图像。(c) 纸基装置在不同CIM-EC浓度下的平均光密度值。插图:Z3区域在不同CIM-EC浓度下的图像。
最后,我们验证了这种集成的纸基设备在尿液样本中检测大肠杆菌的实际应用。我们分析了从医院患者中收集的40份尿液样本,这些样本包括细菌阴性(培养-)、大肠杆菌阴性但细菌阳性(培养+/EC-)和大肠杆菌阳性并带有黄色菌落(培养+/EC+)。整个操作流程包括:(1)细胞收集(10 min);(2)细胞裂解(10 min);(3)纸基检测(35 min)(图5a)。如图5b所示,19份培养阴性样本和6份培养+/EC-样本未显示明显的颜色变化,而15份培养+/EC+样本产生了明显的蓝色反应。通过标准曲线,可以实现阳性临床样本的半定量检测,标准曲线由平均光密度与大肠杆菌细胞数之间的关系得出(图5c)。与尿液培养的金标准相比,我们实现了100%的临床灵敏度和100%的特异性(图5d)。
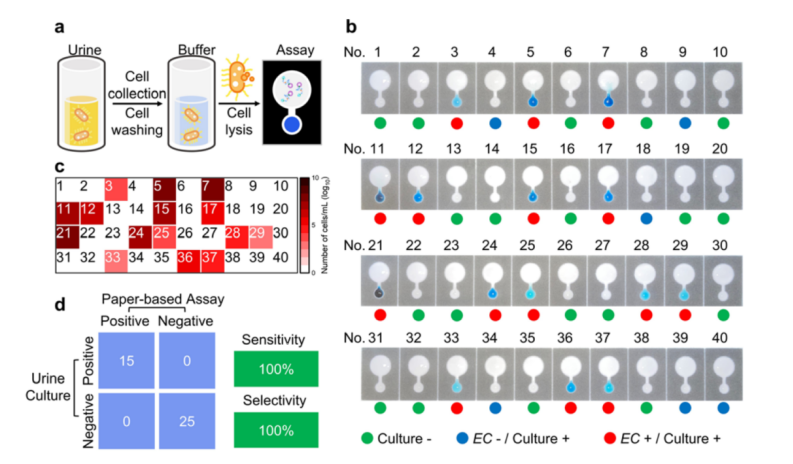
图5 (a) 纸基装置检测临床尿液样本中大肠杆菌的操作步骤。(b) 临床尿液样本中大肠杆菌定量热图。(c) 反应30 min后纸基装置对尿液样本制备的 CIM 的颜色反应。(d) 金标准培养方法和纸基检测法的选择性和灵敏度比较。
综上所述,该研究报告了一种利用MaRCD-EC1进行大肠杆菌检测的无扩增比色分析。在大肠杆菌存在的情况下,固定的MaRCD-EC1被激活,裂解RNA底物,从而释放HRP标记的DNA探针。释放的HRP在pH5.3的条件下催化TMB的氧化,允许肉眼读取结果而无需复杂设备。这种HRP链接的DNA酶无扩增策略在酸性条件下从未被报道。MaRCD-EC1和HRP在酸性条件下表现出最高的催化活性,使得该检测方法在30 min内实现快速和高灵敏度(102 CFU/mL)的检测。基于此开发了一种用于POCT应用的纸基装置,其中HRP@MaRCD-EC1作为识别元件,TMB作为显色底物集成在一起。对40份患者尿液样本的临床评估表明,该纸基装置的临床灵敏度为100%,特异性为100%。此外,该装置在室温下储存至少30 d,保持稳定。综上所述,该装置凭借高灵敏度、便携性、操作简便以及快速的检测时间,具有在偏远和资源匮乏地区诊断应用的潜力。
论文来源:https://doi.org/10.1039/d4cc01150c
来源:微生物安全与健康网,作者~段子璇。





