科研干货 | 养好THP-1细胞的关键
发布时间:2025-01-06 浏览次数:2527
为了成功地培养THP-1细胞,以下是一些重要的注意事项:
首先,在培养基的配制上,建议使用1640培养基并加入10%血清或血清替代品,同时添加0.05mM的β-巯基乙醇。对THP-1细胞来说,血清质量的选择非常关键,因此要确保使用高质量的血清或血清替代品,比如XR血清替代品,来提供细胞所需的营养和生长因子。 其次,在培养过程中要注意定期进行液体更换和细胞传代。建议使用非TC处理的培养瓶,并避免频繁的离心操作以减少机械损伤。在换液时,可以采用补液法或半换液法,同时注意维持适当的细胞密度以促进细胞生长。 对于细胞传代,可以选择直接分瓶或离心法,确保细胞均匀并且细胞密度适中。另外,冻存时应使用预先配制的冻存液(例如DMSO)来保存细胞,并注意避免使用无血清冻存液,因为这可能导致细胞失活。 
最后,要特别注意添加β-巯基乙醇到培养基中,因为THP-1细胞对氧化敏感,而β-巯基乙醇可以保护细胞免受氧化应激的损伤,有助于维持细胞内环境稳定。综合来看,选择合适的培养基组分、培养条件和操作方法将有助于养好THP-1细胞并维持其良好的生长状态。
1. 培养基准备
基础培养基:使用RPMI 1640培养基,添加10%胎牛血清(FBS)和1%青霉素-链霉素双抗。 抗氧化剂:加入0.05mM β-巯基乙醇(β-mercaptoethanol),但由于其不稳定性,建议在使用前新鲜配制。
2. 细胞密度
密度依赖性:THP-1细胞对密度非常敏感,建议保持在5×105到1×106细胞/mL之间。 传代:当细胞密度超过1×106细胞/mL时,需要进行传代。一般1:2传代。
3. 培养条件
酸性环境:THP-1细胞在偏酸性环境中生长较好。当培养基变黄(橘红色)时,可以补充新鲜培养基或进行半换液。 温度和CO2:培养温度保持在37°C,5% CO2环境中。
4. 冻存与复苏
冻存:使用无血清冻存液,细胞密度控制在约5×106细胞/mL。复苏时,150G离心3分钟。 复苏后处理:复苏后48小时内尽量不对细胞进行操作,以便细胞恢复。
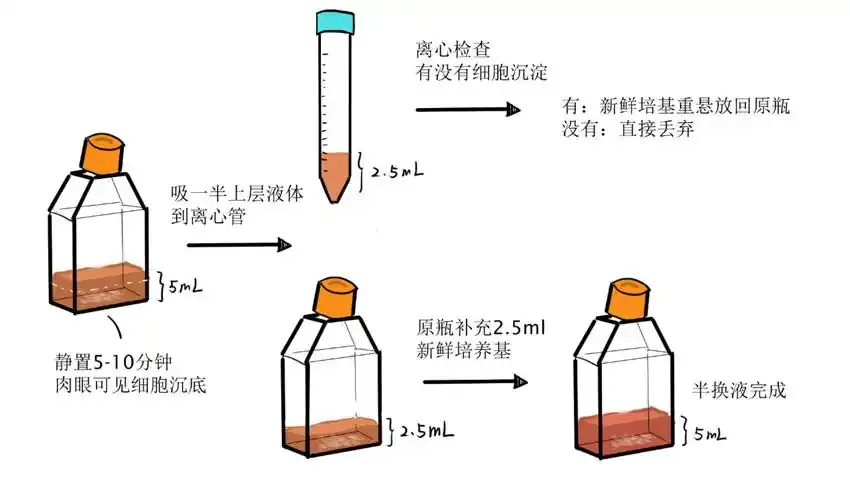
5. 常见问题及解决
细胞聚团:这是正常现象,无需吹散。可以轻轻晃动培养瓶或孔板,使细胞均匀分布。 小黑点:可能是污染或细胞碎片。建议更换培养基并观察,如果持续出现,可能需要丢弃培养。
如何检测THP-1细胞的分化状态?
1. 形态学观察
显微镜观察:分化后的THP-1细胞会从悬浮状态变为贴壁状态,细胞形态由圆形变为不规则形态,体积增大,细胞浆疏松,细胞核增大。
2. 表面标志物检测
流式细胞术:使用流式细胞术检测特定的表面标志物,如CD11b和CD14,这些标志物在分化为巨噬细胞后会显著表达。 免疫荧光染色:通过免疫荧光染色检测细胞表面和细胞内的特定蛋白质表达情况。
3. 功能性检测
吞噬能力测试:分化后的巨噬细胞具有吞噬能力,可以通过吞噬荧光微珠或细菌来检测其功能。 酶活性检测:检测分化后细胞的特定酶活性,如酸性磷酸酶活性。
4. 基因表达分析
qPCR:通过定量PCR检测分化相关基因的表达水平,如TNF-α、IL-1β等。 Western Blot:检测分化相关蛋白质的表达水平。

注意事项
1.形态学观察
显微镜观察:分化后的THP-1细胞会从悬浮状态变为贴壁状态,细胞形态由圆形变为不规则形态,体积增大,细胞浆疏松,细胞核增大。
2. 表面标志物检测
流式细胞术:使用流式细胞术检测特定的表面标志物,如CD11b和CD14,这些标志物在分化为巨噬细胞后会显著表达。 免疫荧光染色:通过免疫荧光染色检测细胞表面和细胞内的特定蛋白质表达情况。
3. 功能性检测
吞噬能力测试:分化后的巨噬细胞具有吞噬能力,可以通过吞噬荧光微珠或细菌来检测其功能。 酶活性检测:检测分化后细胞的特定酶活性,如酸性磷酸酶活性。
4. 基因表达分析
qPCR:通过定量PCR检测分化相关基因的表达水平,如TNF-α、IL-1β等。 Western Blot:检测分化相关蛋白质的表达水平。
声明:本文来源网络,仅用于交流学习,如涉及侵权,请联系删除。






